Dette er et søkefelt med autofullføringsforslag. Start å skrive og du vil få opp forslag på virkestoff, legemidler og bruksområder, som du kan velge mellom. Bruk Søke-knappen hvis autofullføringsforslagene ikke er relevante, eller Strekkode-knappen hvis du ønsker å skanne strekkoden på legemiddelpakningen.
INJEKSJONSVÆSKE, oppløsning i ferdigfylt penn 200 mg: Hver ferdigfylte penn (1 ml) inneh.: Certolizumab pegol 200 mg, natriumacetat, natriumklorid, vann til injeksjonsvæsker.
INJEKSJONSVÆSKE, oppløsning i ferdigfylt sprøyte 200 mg: Hver ferdigfylte sprøyte (1 ml) inneh.: Certolizumab pegol 200 mg, natriumacetat, natriumklorid, vann til injeksjonsvæsker.
Indikasjoner
- Revmatoid artritt: I kombinasjon med metotreksat til behandling av moderat til alvorlig, aktiv revmatoid artritt (RA) hos voksne som ikke har hatt tilstrekkelig respons på sykdomsmodifiserende antirevmatiske legemidler (DMARD), inkl. metotreksat. Kan gis som monoterapi ved intoleranse for metotreksat eller når fortsatt behandling med metotreksat er uegnet. I kombinasjon med metotreksat til behandling av alvorlig, aktiv og progredierende RA hos voksne som ikke tidligere er behandlet med metotreksat eller andre DMARD. Det er vist at Cimzia gitt i kombinasjon med metotreksat reduserer progresjonshastigheten av skade i ledd målt vha. røntgen, og forbedrer den fysiske funksjonen.
- Aksial spondylartritt: Behandling av voksne med alvorlig, aktiv aksial spondylartritt, som omfatter: Ankyloserende spondylitt (også kjent som Bekhterevs sykdom eller radiografisk aksial spondylartritt): Voksne med alvorlig, aktiv ankyloserende spondylitt som ikke har hatt tilstrekkelig respons på eller er intolerante overfor NSAID. Aksial spondylartritt uten radiografisk påvist ankyloserende spondylitt (også kjent som ikke-radiografisk aksial spondylartritt): Voksne med alvorlig, aktiv aksial spondylartritt uten radiografisk påvist ankyloserende spondylitt, men med objektive tegn på inflammasjon vist ved forhøyet CRP og/eller MRI, og som ikke har hatt tilstrekkelig respons på eller er intolerante overfor NSAID.
- Psoriasisartritt: I kombinasjon med metotreksat til behandling av aktiv psoriasisartritt hos voksne som ikke har hatt tilstrekkelig respons på tidligere DMARD-behandling. Kan gis som monoterapi ved intoleranse for metotreksat eller når fortsatt behandling med metotreksat er uegnet.
- Plakkpsoriasis: Behandling av moderat til alvorlig plakkpsoriasis hos voksne som er kandidater til systemisk behandling.
De regionale helseforetakenes anbefalinger
Dosering
Mht. sporbarhet skal preparatnavn og batchnr. noteres i pasientjournalen. Behandling skal igangsettes og gjennomføres under tilsyn av spesialist med erfaring i diagnostisering og behandling av tilstander preparatet er indisert for. Pasienten skal gis et spesielt pasientkort.
Ladningsdose hos voksne
Revmatoid artritt, psoriasisartritt, aksial spondylartritt og plakkpsoriasis: Anbefalt startdose er 400 mg (gitt som 2 s.c. injeksjoner à 200 mg) ved uke 0, 2 og 4. Ved revmatoid artritt og psoriasisartritt bør metotreksat fortsatt gis når dette er egnet.
Vedlikeholdsdose hos voksne
Revmatoid artritt: Anbefalt vedlikeholdsdose er 200 mg annenhver uke. Så snart klinisk respons er bekreftet, kan vedlikeholdsdose på 400 mg hver 4. uke vurderes. Metotreksat bør fortsatt gis når dette er egnet. Klinisk respons oppnås vanligvis innen 12 uker. Videre behandling bør revurderes nøye ved manglende effekt innen de første 12 ukene. Aksial spondylartritt: Anbefalt vedlikeholdsdose er 200 mg annenhver uke eller 400 mg hver 4. uke. Etter minst 1 års behandling med Cimzia hos pasienter med opprettholdt remisjon, kan en redusert vedlikeholdsdose på 200 mg hver 4. uke vurderes. Klinisk respons oppnås vanligvis innen 12 uker. Videre behandling bør revurderes nøye ved manglende effekt innen de første 12 ukene. Psoriasisartritt: Anbefalt vedlikeholdsdose er 200 mg annenhver uke. Så snart klinisk respons er bekreftet, kan vedlikeholdsdose på 400 mg hver 4. uke vurderes. Metotreksat bør fortsatt gis når dette er egnet. Klinisk respons oppnås vanligvis innen 12 uker. Videre behandling bør revurderes nøye ved manglende effekt innen de første 12 ukene. Plakkpsoriasis: Vedlikeholdsdosen er 200 mg annenhver uke. En vedlikeholdsdose på 400 mg annenhver uke kan vurderes ved utilstrekkelig respons. Klinisk respons vanligvis oppnås innen 16 uker. Fortsatt behandling bør vurderes nøye ved manglende effekt innen de første 16 ukene. Noen pasienter med en innledende delvis respons kan senere bli bedre ved fortsatt behandling utover 16 uker.
Glemt dose Ved uteglemt dose bør neste dose injiseres snarest og påfølgende doser gis som planlagt.
Spesielle pasientgrupper
- Nedsatt lever-/nyrefunksjon: Ikke undersøkt.
- Barn og ungdom <18 år: Sikkerhet og effekt ikke fastslått.
- Eldre ≥65 år: Dosejustering ikke nødvendig.
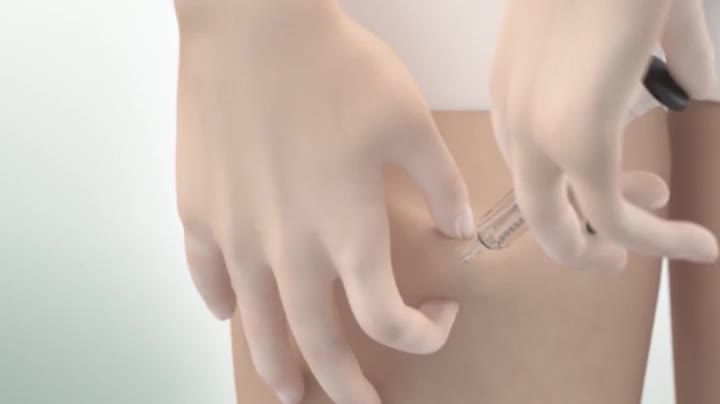
Administrering Det totale innholdet (1 ml) i pennen/sprøyten skal gis kun som s.c. injeksjon. Kan injiseres i låret eller magen. Etter tilstrekkelig opplæring kan pasienten selv injisere, dersom dette er formålstjenlig og medisinsk oppfølging gis ved behov. Legen bør diskutere med pasienten om hvilken injeksjonsmetode som egner seg best. Se pakningsvedlegg for bruksanvisning.
Kontraindikasjoner
Overfølsomhet for innholdsstoffene. Aktiv tuberkulose eller andre alvorlige infeksjoner, som sepsis eller opportunistiske infeksjoner. Moderat til alvorlig hjertesvikt (NYHA III/IV).Forsiktighetsregler
Infeksjoner: Pasienten må følges nøye mht. tegn og symptomer på infeksjon, inkl. tuberkulose, før, under og i opptil 5 måneder etter behandling. Behandling må ikke igangsettes før ev. aktiv kronisk eller lokal infeksjon av klinisk betydning er under kontroll. Pasienter som utvikler ny infeksjon under behandling bør følges nøye. Ved utvikling av ny alvorlig infeksjon bør administrering utsettes inntil infeksjonen er under kontroll. Forsiktighet bør utvises når behandling overveies hos pasienter med tidligere gjentatte eller opportunistiske infeksjoner eller predisposisjon for infeksjoner, inkl. samtidig bruk av immunsuppressiver. Pasienter med revmatoid artritt kan pga. sykdommen og samtidig behandling, mangle typiske symptomer på infeksjon, inkl. feber. Tidlig påvisning av alle infeksjoner, spesielt atypiske forekomster av alvorlig infeksjon, er derfor avgjørende for å minimere forsinket diagnostisering og behandlingsoppstart. Alvorlig infeksjon, inkl. sepsis og tuberkulose (miliær, disseminert, ekstrapulmonal), samt opportunistiske infeksjoner (f.eks. histoplasmose, nocardia, candidiasis), er rapportert, enkelte fatale tilfeller. Tuberkulose: Før behandlingsoppstart må både aktiv og latent tuberkuloseinfeksjon utredes med detaljert sykdomshistorie hos pasienter med en personlig historie med tuberkulose, eller mulig tidligere eksponering for pasienter med aktiv tuberkulose og tidligere, og/eller pågående immunsuppressiv behandling. Screening, f.eks. tuberkulintest og røntgen thorax, av alle pasienter bør gjøres iht. lokale anbefalinger (registreres i pasientkortet). Risiko for falske negative resultater av tuberkulintester, spesielt hos alvorlig syke eller immunkompromitterte. Ved diagnostisert aktiv tuberkulose før eller under behandling, må behandlingen ikke igangsettes, eller den må avbrytes. Ved mistenkt latent tuberkulose bør spesialist innen behandling av tuberkulose konsulteres. Nytte-/risikoforholdet av behandlingen bør vurderes svært nøye i tilfellene beskrevet nedenfor. Ved diagnostisert latent tuberkulose må egnet antituberkulosebehandling igangsettes iht. lokale anbefalinger før behandlingsoppstart. Antituberkulosebehandling bør også overveies før behandlingsoppstart ved tidligere latent eller aktiv tuberkulose, der adekvat behandling ikke er bekreftet, og ved betydelige risikofaktorer for tuberkulose til tross for negativ test for latent tuberkulose. Biologiske tester for tuberkulosescreening bør overveies før behandlingsoppstart ved potensiell latent tuberkuloseinfeksjon, uten hensyn til BCG-vaksinering. Til tross for tidligere/samtidig profylaktisk behandling av tuberkulose, har aktiv tuberkulose forekommet ved behandling med TNF-antagonister, inkl. certolizumab pegol. Enkelte som har gjennomgått vellykket behandling av aktiv tuberkulose har utviklet tuberkulose på nytt under behandling med certolizumab pegol. Pasienten skal søke medisinsk hjelp ved tegn/symptomer (f.eks. vedvarende hoste, tap av muskler og fett-/vekttap, lett feber, likegyldighet) på tuberkuloseinfeksjon under eller etter behandling. Reaktivering av hepatitt B-virus (HBV): Reaktivering av HBV (noen fatale tilfeller) kan forekomme hos kroniske virusbærere (overflateantigenpositive) som behandles med TNF-antagonister. Pasienter bør testes for HBV-infeksjon før behandlingsoppstart. Ved positiv test for HBV-infeksjon bør pasienten konsultere lege med ekspertise innen HBV-behandling. HBV-bærere bør overvåkes nøye mht. tegn/symptomer på aktiv HBV-infeksjon, under behandling og i flere måneder etter avsluttet behandling. Ingen adekvate data finnes vedrørende forhindring av HBV-aktivering ved antiviral behandling samtidig med TNF-antagonister. Ved HBV-reaktivering bør behandlingen stoppes og effektiv antiviral behandling med egnet støttebehandling igangsettes. Maligniteter og lymfoproliferativ sykdom: Forsiktighet bør utvises ved behandling av pasienter med tidligere malignitet eller når fortsatt behandling overveies hos pasienter som utvikler malignitet. Risiko for utvikling av lymfomer, leukemi eller andre maligniteter kan ikke utelukkes. Økt underliggende risiko for lymfom og leukemi hos pasienter med revmatoid artritt med langvarig, svært aktiv inflammatorisk sykdom, gjør risikovurderingen mer komplisert. Hudkreft: Melanom og merkelcellekarsinom er rapportert ved behandling med certolizumab pegol, og regelmessig hudundersøkelse anbefales, spesielt ved risikofaktorer for hudkreft. Maligniteter i pediatrisk populasjon: Maligniteter, noen av dem fatale, er sett hos barn, ungdom og yngre voksne (<22 år) etter behandling med TNF-antagonister (behandlingsstart ≤18 år). Ca. 50% av tilfellene var lymfomer, resten var ulike maligniteter inkl. sjeldne som vanligvis forbindes med immunsuppresjon. Risiko for utvikling av maligniteter hos barn og ungdom ved behandling med TNF-antagonister kan ikke utelukkes. Hepatosplenisk T-cellelymfom (HSTCL) er sett etter behandling med TNF-antagonister. Dette har et svært aggressivt sykdomsforløp, vanligvis med dødelig utfall. De fleste tilfellene oppsto hos ungdom og unge voksne menn med Crohns sykdom eller ulcerøs kolitt. Nesten alle hadde fått immunsuppressivene azatioprin og/eller 6-merkaptopurin samtidig med en TNF-antagonist ved eller før diagnosetidspunktet. Risiko for utvikling av HSTCL ved behandling med certolizumab pegol kan ikke utelukkes. Kols: Pga. risiko for ytterligere malignitet bør forsiktighet utvises ved bruk hos kols-pasienter og ved økt risiko for malignitet pga. av mye røyking. Kongestiv hjertesvikt: Bør brukes med forsiktighet ved lett hjertesvikt (NYHA klasse I/II). Behandling må avbrytes ved utvikling av nye eller forverrede symptomer på kongestiv hjertesvikt. Hematologiske reaksjoner: Pasienten bør rådes til å søke øyeblikkelig medisinsk hjelp ved tegn/symptomer på bloddyskrasier eller infeksjon (f.eks. vedvarende feber, blåmerker, blødning, pallor). Behandlingen bør ev. avbrytes ved bekreftede signifikante hematologiske avvik. Nevrologiske hendelser: Hos pasienter som allerede har eller nylig har fått demyeliniserende sykdom, bør fordeler/risiko ved behandling med TNF-antagonist vurderes nøye før behandlingsoppstart. Overfølsomhet: Alvorlig overfølsomhetsreaksjon kan oppstå allerede etter 1. administrering. Ved alvorlig overfølsomhetsreaksjon bør behandlingen avbrytes umiddelbart og egnet behandling igangsettes. Forsiktighet må utvises ved alvorlig overfølsomhetsreaksjon på annen TNF-antagonist. Immunsuppresjon: Kan forårsake immunsuppresjon og dermed påvirke forsvaret mot infeksjoner og maligniteter. Autoimmunitet: Behandling kan føre til dannelse av antinukleære antistoffer og til utvikling av lupuslignende syndrom. Effekt av langtidsbehandling på utvikling av autoimmun sykdom er ukjent. Ved symptomer på lupuslignende syndrom må behandlingen avbrytes. Kirurgi: Begrenset erfaring med sikkerheten av kirurgiske inngrep under behandlingen. Halveringstiden på 14 dager bør tas i betraktning ved planlegging av kirurgiske inngrep. Under kirurgi bør pasienten følges nøye mht. infeksjoner, og nødvendige tiltak iverksettes. Eldre: Forsiktighet bør utvises ved behandling av eldre, spesielt mht. forekomst av infeksjoner. Immunogenisitet: Dannelse av antistoffer, og i enkelte tilfeller redusert effekt, er sett i langtidsstudier (ca. 4-5 år). Tester med aktivert partiell tromboplastintid (aPTT): Tolkning av unormale resultater i aPTT-tester bør gjøres med forsiktighet pga. interferens med enkelte koagulasjonstester. Kan gi feilaktig forhøyede resultater i aPTT-tester hos pasienter uten koagulasjonsforstyrrelser. Dette er sett med PTT-lupus antikoagulant (LA)-test og «Standard Target Activated Partial Thromboplastin time (STA-PTT) Automate»-tester fra Diagnostica Stago og «HemosIL APTT-SP liquid»- og «HemosIL lyophilised silica»-tester fra Instrumentation Laboratories. Andre aPTT-tester kan også påvirkes. Bilkjøring og bruk av maskiner: Preparatet kan gi svimmelhet (inkl. vertigo, synsforstyrrelser, fatigue), som kan påvirke evnen til å kjøre bil og bruke maskiner.Interaksjoner
Graviditet, amming og fertilitet
GraviditetBør kun brukes under graviditet hvis klinisk nødvendig. Bruk av sikker prevensjon bør vurderes for kvinner i fertil alder. Kvinner som planlegger å bli gravide, bør vurdere å fortsette med prevensjon i ≥5 måneder etter avsluttet behandling, men behandlingsbehovet skal også tas i betraktning. Levende/svekkede vaksiner bør ikke gis før ≥5 måneder etter siste dose under graviditet, med mindre fordel klart overgår teoretisk risiko for spedbarnet.
AmmingKan brukes under amming.
FertilitetIngen merkbar effekt er sett på fertilitet hos dyr. Ingen effekt er sett på sædkvalitet hos menn.
Bivirkninger
Frekvensintervaller: Svært vanlige (≥1/10), vanlige (≥1/100 til <1/10), mindre vanlige (≥1/1000 til <1/100), sjeldne (≥1/10 000 til <1/1000), svært sjeldne (<1/10 000) og ukjent frekvens.
Overdosering/Forgiftning
BehandlingNøye oppfølging og symptomatisk behandling igangsettes umiddelbart.
Egenskaper og miljø
KlassifiseringTumornekrosefaktor alfa (TNF-α)-hemmer. Fab'-fragment av rekombinant, humanisert antistoff mot TNF-α konjugert til polyetylenglykol (PEG).
VirkningsmekanismeBindes med høy affinitet til TNF-α og nøytraliserer selektivt og doseavhengig både membranassosiert og fritt TNF-α. Inkubering av monocytter med certolizumab pegol fører til doseavhengig inhibering av lipopolysakkarid (LPS)-indusert TNF-α- og IL1β-produksjon i humane monocytter. Inneholder ikke Fc-region, og binder derfor ikke komplement eller forårsaker antistoffavhengig cellemediert cytotoksisitet in vitro. Induserer ikke apoptose in vitro i humane perifere monocytter eller lymfocytter, eller nøytrofil degranulering.
AbsorpsjonCmax nås 54-171 timer etter s.c. injeksjon. Biotilgjengelighet: Ca. 80% (76-88%).
FordelingVd: 8,01 liter.
HalveringstidCa. 14 dager. Forsinket eliminering av Fab'-fragmentet pga. PEG-enheten. Plasmaclearance ca. 21 ml/time, interindividuell variasjon 30,8%, intraindividuell variasjon 22%. 3 ganger så høy clearance ved tilstedeværelse av antistoffer mot certolizumab pegol.
UtskillelseDekonjugert PEG elimineres raskt fra plasma og utskilles i urin i ukjent grad.
Pakninger, priser og refusjon
Cimzia, INJEKSJONSVÆSKE, oppløsning i ferdigfylt penn:
| Styrke | Pakning Varenr. |
Refusjon | Pris (kr) | R.gr. |
|---|---|---|---|---|
| 200 mg | 2 × 1 ml (ferdigfylt penn) 429168 |
9 844,70 | C |
Cimzia, INJEKSJONSVÆSKE, oppløsning i ferdigfylt sprøyte:
| Styrke | Pakning Varenr. |
Refusjon | Pris (kr) | R.gr. |
|---|---|---|---|---|
| 200 mg | 2 × 1 ml (ferdigfylt sprøyte) 060597 |
9 844,70 | C |
SPC (preparatomtale)
Cimzia INJEKSJONSVÆSKE, oppløsning i ferdigfylt penn 200 mg Cimzia INJEKSJONSVÆSKE, oppløsning i ferdigfylt sprøyte 200 mg |
Basert på SPC godkjent av DMP/EMA:
23.06.2022
Sist endret: 18.10.2021
(priser og ev. refusjon oppdateres hver 14. dag)